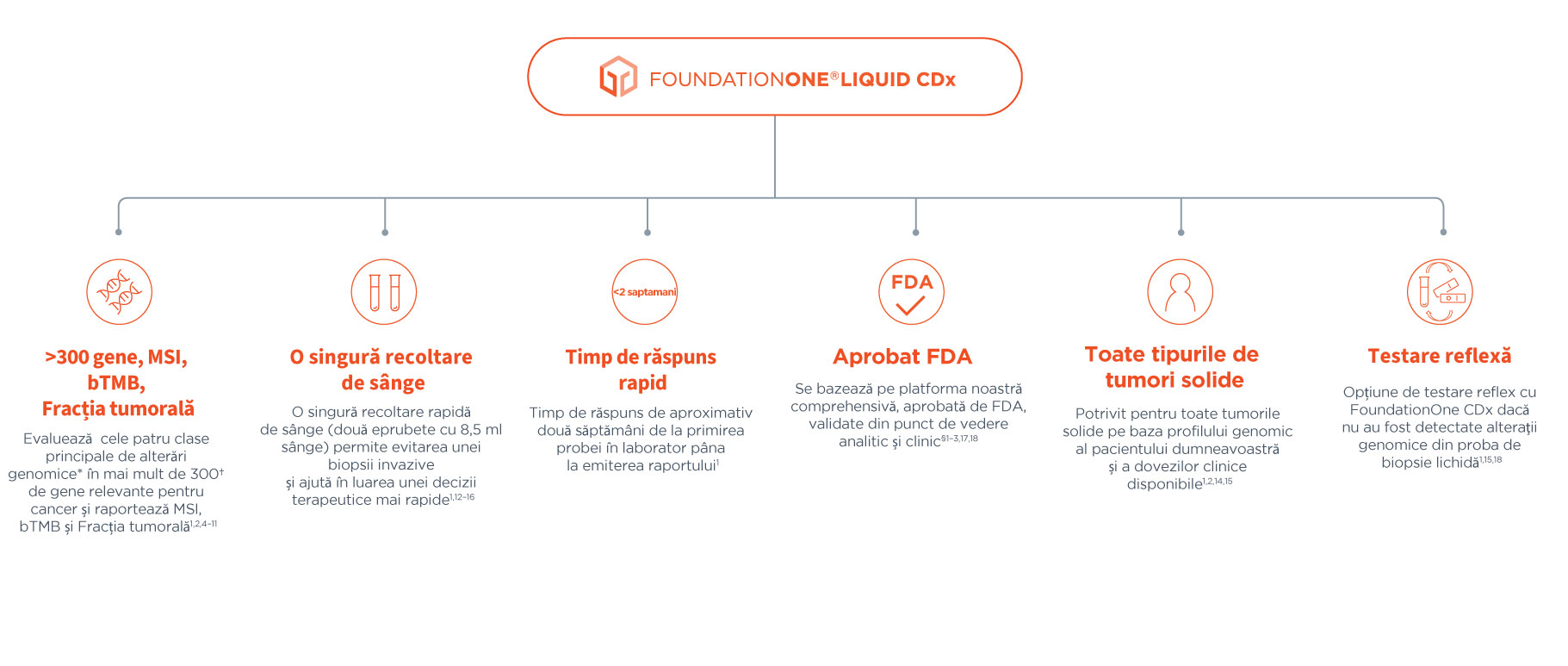
*Substituții de baze, inserții sau deleții, variații ale numărului de copii și rearanjări de gene.
†309 gene cu acoperire completă a codărilor exonice, 15 gene cu regiuni selectate intronice sau necodificate.
‡FoundationOne Liquid CDx raportează statusul MSI High
§Validare bazată pe un total de > 7.500 de eșantioane care acoperă> 30.000 de variante unice în > 300 de gene și 37 de indicații de cancer.
¥75 de gene sunt catalogate cu o sensibilitate sporită pentru toate tipurile de variante (selectate pe baza unei acționări sporite cu terapii actuale sau viitoare; pentru mai multe informații despre aceste 75 de gene, vă rugăm să consultați lista noastră completă de gene); alte regiuni genomice sunt catalogate cu sensibilitate ridicată.
¶Validare clinică bazată pe dovezi colectate folosind o versiune anterioară a serviciului curent de biopsie lichidă Foundation Medicine, FoundationOne Liquid CDx. Pentru rezultatele concordanței dintre aceste două teste, vă rugăm să consultați utilizarea noastră completă la: www.foundationmedicine.qarad.eifu.online/foundationmedicine/en/ foundationmedicine.
‖Terapiile conținute în versiunea UE a raportului pot fi aprobate printr-o procedură centralizată a UE sau printr-o procedură națională într-un stat membru al UE.
**Pentru informații suplimentare despre categoriile NCCN, vă rugăm să consultați NCCN Compendium® (www.nccn.org).
bTMB, Încărcătura mutaţională la nivel tumoral din sânge; cfDNA, ADN din celule circulante; CGP, Profilare Comprehensivă Genomica; ctDNA, ADN tumoral circulant; d, days-zile; FDA, Agenția pentru Alimente și Medicamente din Statele Unite (US Food and Drug Administration); MSI, Instabilitate microsatelitară satelită; NCCN, Rețeaua Națională Comprehensivă a Cancerului (National Comprehensive Cancer Network) ; NGS, Secvenţiere de ultimă generaţie (next generation sequencing); NSCLC, cancer pulmonar fără celule mici (non-small cell lung cancer).